
Sisu
- TL; DR (liiga pikk; ei lugenud)
- Kuidas mooli arvutada
- Teisendamine Mmoliks
- Lahenduse kontsentratsioon
- Näide
Lihtsalt oma arvutuste jaoks lõid keemikud standardse ühiku reaktsioonis või mõnes muus keemilises protsessis osaleva konkreetse ühendi aatomite arvu kohta. Nad määratlevad ühe mooli (mooli) mis tahes aine hulgana, millel on sama arv põhilisi ühikuid kui 12 grammi süsinik-12, see on Avogadrose arv (6,022 × 1023). SI (meetriline) mõõtesüsteem määratleb millimooli (Mmol) ühe tuhandiku mooliga. Aine moolide arvu arvutate tavaliselt kaaludes teie käes olevat kogust. Kui soovite teisendada Mmoliks, korrutage 10-ga3 (1,000).
TL; DR (liiga pikk; ei lugenud)
Üks mool on võrdne konkreetse ühendi osakeste arvuga Avogadros. Millimool (Mmol) on tuhandik mooli.
Kuidas mooli arvutada
Aatomimassi mõõdetakse aatommassiühikutes (AMU). Üks AMU on täpselt 1/12 süsinik-12 aatomi tuuma massist selle olekus. Aine üks mool on määratletud kui võrdne selle aine osakeste Avogadrosi arvuga. Selle määratluse kohaselt on aine ühe mooli mass grammides sama arv kui selle aine üksiku osakese mass AMU-s. Näiteks süsiniku-12 aatommass on 12 AMU, seega kaalub süsinik-12 üks mool 12 grammi.
Mõelge mahutile, mis on täis vesinikku (H2). Iga anumas olev osake on molekul, mis koosneb kahest vesiniku aatomist, nii et molekulmassi arvutamiseks peate teadma ainult vesiniku aatommassi. Perioodilise tabeli enamikus versioonides loetletakse sümboli all iga elemendi aatommass. Vesiniku puhul, mille tuumas on üks prooton, on selle 1,008 AMU, mis on kõigi vesiniku looduslikult esinevate isotoopide keskmine. Järelikult on vesiniku gaasi aatommass 2,016 AMU ja vesinikgaasi üks mool kaalub 2,016 grammi. Proovis olevate moolide arvu leidmiseks kaalutakse proov grammides ja jagatakse see mass vesiniku molekulmassiga grammides. Näiteks 15 grammi puhast vesinikgaasi sisaldav proov sisaldab 7,44 mooli.
Teisendamine Mmoliks
Mõnikord on uuritavad kogused nii väikesed, et nende väljendamine moolidega on tülikas. Sisestage millimool. Kui korrutada moolide arv tuhandega, saate teisendada väga väikese arvu hallatavamaks. See on eriti mugav, kui käsitletakse ruumalaühikuid milliliitrites.
1 mol = 1000 mmol
Lahenduse kontsentratsioon
Keemikud kasutavad molaarsust konkreetse ühendi kontsentratsiooni mõõtmisel lahuses. Nad määratlevad molaarsuse moolide arvuna liitri kohta. Te teisendate molaarsuse millimolaarsuseks, korrutades selle 1000-ga. Näiteks on 1 mooli (molaarne, kirjutatud ka M) lahuse kontsentratsioon 1 mooli liitri kohta. See on samaväärne 1000 Mmooli (millimolaarne, mõnikord kirjutatud ka kui mM) lahusega, mis sisaldab 1000 Mmooli liitri kohta.
Näide
••• Damien Scogin / Demand Media
Lahus sisaldab 0,15 grammi kaltsiumkarbonaati. Mitu millimooli see on?
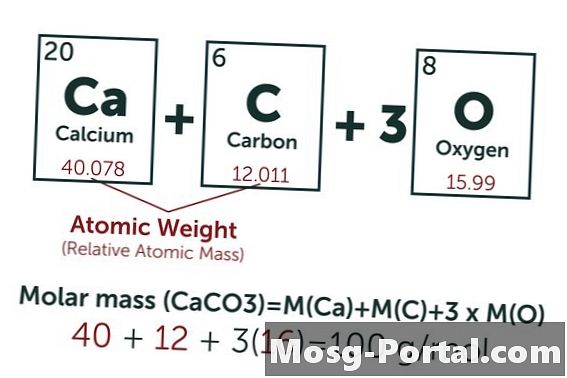
Kaltsiumkarbonaadi keemiline valem on CaCO3. Süsiniku (C) aatommass on umbes 12 AMU, hapniku (O) umbes 16 AMU ja kaltsiumi (Ca) umbes 40 AMU. Iga kaltsiumkarbonaadi molekul kaalub seega 100 AMU, mis tähendab, et üks mool kaalub umbes 100 grammi. Kaal 0,15 grammi tähistab 0,15 g-100 g / mol = 0,0015 mooli. See võrdub 1,5 mmol.
Milline on selle suure kaltsiumkarbonaadi molaarsus ja millimolaarsus 2,5 liitris lahuses?
Molaarsus on määratletud kui moolide arv liitris, nii et molaarsuse saamiseks jagage moolide arv 2,5-ga: 0,0015 ÷ 2,5 =
0,0006 M
Korrutage 1000-ga, et saada millimolaarsus =
0,6 mM
Pange tähele, et sama tulemus saadakse millimolaarsuse korral, kui jagate millimoolide arvu lahuse mahuga.