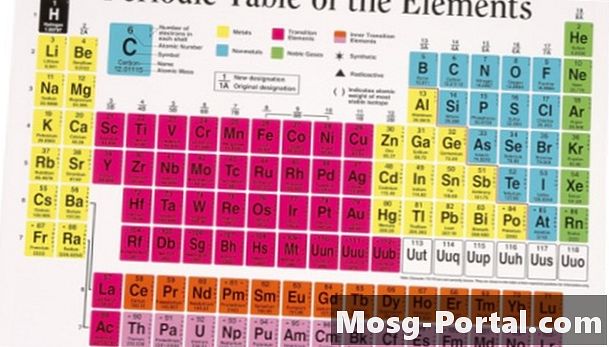
Enamik elemente eksisteerib looduses rohkem kui ühes isotoobis. Looduses esinevate isotoopide arvukus mõjutab elemendi keskmist aatommassi. Periooditabelil leitud aatommassi väärtused on keskmised aatommassid, võttes arvesse erinevaid isotoope. Keskmise aatommassi arvutamisel võetakse kaalutud keskmine arvukuse põhjal. Elementide puhul, millel on ainult üks isotoop, on aatommass tuumas leiduvate prootonite ja neutronite arvu põhjal lähedane väärtusele, mida võiks eeldada.
Otsige huvipakkuva elemendi võimalikku isotoopi. Kõigil elementidel on üks isotoop ja mõnel on kaks või enam isotoopi. Keskmise aatommassi arvutamiseks peate teadma, kui palju isotoope seal on, nende arvukust ja aatommassi.
Leidke iga isotoobi looduslik arvukus. Need arvukused registreeritakse elemendi isotoobi numbriga.
Aatommassi arvutamiseks kasutatakse kaalutud keskmist. Kaalutud keskmise tabelisse saamiseks korrutage isotoobid iga protsendilise arvukusega. Pange kokku kõigi isotoopide tulemused. Näiteks leidke magneesiumi keskmine aatommass. Magneesiumi kolm isotoopi on Mg (24), Mg (25) ja Mg (26). Kõigi nende isotoopide arvukus ja massiprotsent Mg (24) on 78,9 protsenti 23,985 juures, Mg (25) on 10,0 protsenti 24,986 juures ja Mg (26) on 11,1 protsenti 25,983 juures.Kaalutud keskmine arvutatakse järgmiselt: (protsenti 1 * aatommassist) + (protsenti 2 * aatommassist) + (protsenti 3 * aatommassist) = (0,789 * 23,985) + (0,100 * 24,986) + (0,111 * 25,983) = (18,924 + 2,499 + 2,884) = 24,307. Avaldatud väärtus on 24.305. Ümardamisvead võivad hõlmata väikest erinevust.