Sisu
Ensüümid on elusate süsteemide kriitilised valgu molekulid, mida pärast sünteesimist tavaliselt ei muundata mingiks teist tüüpi molekuliks, nagu ka seede- ja hingamisprotsessides kütusena kasutatavaid aineid (nt suhkrud, rasvad, molekulaarne hapnik). Seda seetõttu, et ensüümid on katalüsaatorid, mis tähendab, et nad saavad osaleda keemilistes reaktsioonides ilma, et neid ise muudetaks, nagu avaliku arutelu moderaator, kes ideaalis liigutab osalejaid ja publikut järelduse poole, dikteerides argumendi tingimused, lisamata samas ainulaadset teavet.
On tuvastatud üle 2000 ensüümi ja igaüks neist on seotud ühe konkreetse keemilise reaktsiooniga. Ensüümid on seetõttu substraadispetsiifilised. Nad on jaotatud pooleks tosinklassiks nende reaktsioonide põhjal, milles nad osalevad.
Ensüümi põhitõed
Ensüümid võimaldavad kehas tohutul hulgal reaktsioone homöostaasvõi üldine biokeemiline tasakaal. Näiteks toimivad paljud ensüümid kõige paremini pH (happesuse) tasemel, mis on lähedal sellele, mida keha tavaliselt hoiab, ehk vahemikus 7 (see tähendab, et see pole leeliseline ega happeline). Muud ensüümid toimivad kõige paremini madala keskkonna (kõrge happesusastmega) korral nende keskkonna nõudmiste tõttu; näiteks mao sisemus, kus toimivad mõned seedeensüümid, on väga happeline.
Ensüümid osalevad protsessides alates vere hüübimisest kuni DNA sünteesini kuni seedimiseni. Mõnda leidub ainult rakkudes ja nad osalevad väikeste molekulidega seotud protsessides, näiteks glükolüüs; teised sekreteeritakse otse soolestikku ja toimivad lahtiselt, näiteks neelatud toidu kaudu.
Kuna ensüümid on üsna kõrge molekulmassiga valgud, on neil kõigil erinev kolmemõõtmeline kuju. See määrab konkreetsed molekulid, millel nad toimivad. Lisaks sellele, et enamus ensüüme on pH-st sõltuvad, on nad ka temperatuurist sõltuvad, mis tähendab, et need toimivad kõige paremini üsna kitsas temperatuurivahemikus.
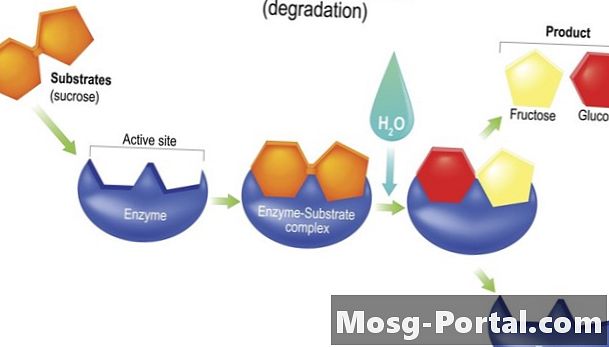
Kuidas ensüümid töötavad
Enamik ensüüme töötab, alandades aktiveerimise energia keemilise reaktsiooni. Mõnikord viib nende kuju reagendid reageerivad füüsiliselt üksteisele kokku näiteks spordimeeskonna treeneri või töörühmajuhi stiilis eesmärgiga ülesanne kiiremini täita. Arvatakse, et kui ensüümid seovad reagendiga, siis nende kuju muutub viisil, mis destabiliseerib reagenti ja muudab selle vastuvõtlikumaks keemiliste muutuste suhtes, mida reaktsioon hõlmab.
Reaktsioone, mis võivad toimuda ilma energia sisendita, nimetatakse eksotermilisteks reaktsioonideks. Nendes reaktsioonides on toodetel või reaktsiooni käigus moodustunud kemikaalidel vähem keemiatasemeid kui kemikaalidel, mida kasutatakse reaktsiooni koostisosadena. Sel moel "molekulid", nagu vesi, "otsivad" oma (energia) taset; aatomid "eelistavad" olla väiksema koguenergiaga korraldustes, nagu vesi voolab allamäge madalaima võimaliku füüsikalise punktini. Kõike seda kokku võttes on selge, et eksotermilised reaktsioonid kulgevad alati loomulikult.
Fakt, et reaktsioon toimub ka ilma sisendita, ei ütle midagi selle toimumise kiiruse kohta. Kui kehasse sattunud aine muutub loomulikult kaheks derivaadiks, mis võivad olla otseseks rakulise energia allikaks, siis pole sellest suurt kasu, kui reaktsiooni loomulikuks toimumiseks kulub tundide või päevade jooksul. Ka siis, kui toodete koguenergia on suurem kui reagentidel, pole energiateekond graafiku sujuv allamäge tõus; selle asemel peavad tooted saavutama kõrgema energiataseme kui see, millega nad alustasid, et nad saaksid "küürust üle" ja reaktsioon saaks toimuda. See energia algne investeerimine reagentidesse, mis tasub end toodete kujul ära, on eespool nimetatud aktiveerimise energiavõi Ea.
Ensüümide tüübid
Inimkeha sisaldab kuut peamist ensüümide rühma või klassi.
Oksidoreduktaasid kiirendada oksüdatsiooni- ja redutseerimisreaktsioonide kiirust. Nendes reaktsioonides, mida nimetatakse ka redoksreaktsioonideks, loobub üks reagentidest elektronide paarist, mille teine reagent võidab. Öeldakse, et elektronipaari doonor on oksüdeerunud ja toimib redutseerijana, samas kui elektronipaari retsipienti taandatakse, nimetatakse oksüdeerivaks aineks. Selgemaks viisiks on see, et sellistes reaktsioonides liiguvad hapnikuaatomid, vesinikuaatomid või mõlemad. Näited hõlmavad tsütokroomoksüdaasi ja laktaatdehüdrogenaasi.
Transferaasid kiirus aatomirühmade, näiteks metüül (CH3), atsetüül (CH3CO) või amino (NH2) rühmad, ühest molekulist teise. Atsetaadikinaas ja alaniindeaminaas on transferaaside näited.
Hüdrolaasid kiirendada hüdrolüüsireaktsioone. Hüdrolüüsireaktsioonides kasutatakse vett (H2O) sideme poolitamiseks molekulis kahe tütarprodukti moodustamiseks, tavaliselt kinnitades veest ühele produktile -OH (hüdroksüülrühma) ja teisele ühe -H (vesinikuaatomi). Vahepeal moodustub -H ja -OH komponentide poolt nihutatud aatomitest uus molekul. Seedeensüümid lipaas ja sahharaas on hüdrolaasid.
Lüase kiirendada ühe molekulaarse rühma kaksiksidemele lisamise kiirust või kahe rühma eemaldamist lähedalasuvatest aatomitest, moodustades kaksiksideme. Need toimivad nagu hüdrolaasid, välja arvatud see, et eemaldatud komponent ei ole vee või vee osade poolt asendatud. Sellesse ensüümide klassi kuuluvad oksalaatdekarboksülaas ja isotsitraatlüas.
Isomeraasid kiirendada isomeerimisreaktsioone. Need on reaktsioonid, milles reagendis säilivad kõik algsed aatomid, kuid need paigutatakse ümber, moodustades reagendi isomeeri. (Isomeerid on sama keemilise valemiga, kuid erineva paigutusega molekulid.) Näited hõlmavad glükoosfosfaadi isomeraasi ja alaniini ratsemaasi.
Ligases (nimetatakse ka süntetaasideks) suurendab kahe molekuli liitumiskiirust. Tavaliselt saavutavad nad selleks energia, mis on saadud adenosiintrifosfaadi (ATP) lagunemisel. Ligaaside näideteks on atsetüül-CoA süntetaas ja DNA ligaas.
Ensüümi pärssimine
Lisaks temperatuuri ja pH muutustele võivad muud tegurid põhjustada ensüümide aktiivsuse vähenemist või seiskamist. Allosteeriliseks interaktsiooniks kutsutavas protsessis muutub ensüümi kuju ajutiselt, kui molekul seostub osaga sellest, kus see reageerijaga liitub. See toob kaasa funktsiooni kaotuse. Mõnikord on see kasulik, kui toode ise on allosteeriline inhibiitor, kuna see on tavaliselt märk reaktsioonist, mis on kulgenud punkti, kus lisatooteid enam ei vajata.
Konkurentsivõimelises pärssimises konkureerib regulatiivseks ühendiks nimetatud aine reageerijaga sidumiskoha pärast. See sarnaneb proovile panna mitu tööklahvi korraga ühte luku sisse. Kui piisavalt palju neid regulatiivseid ühendeid liitub piisavalt suurel hulgal esineva ensüümiga, aeglustab või seiskab see reaktsioonitee. See võib olla abiks farmakoloogias, kuna mikrobioloogid saavad konstrueerida ühendeid, mis konkureerivad bakteriaalsete ensüümide sidumissaitidega, muutes bakterid haiguse põhjustamiseks või inimkehas püsimiseks palju raskemaks.
Mittekonkureeriva pärssimise korral seostub inhibeeriv molekul ensüümiga aktiivsest kohast erinevas kohas, sarnaselt allosteerilise interaktsiooni toimumisega. Pöördumatu pärssimine toimub siis, kui inhibiitor seob ensüümi püsivalt või lagundab seda märkimisväärselt, nii et selle funktsioon ei saa taastuda. Nii närvigaas kui ka penitsilliin kasutavad seda tüüpi pärssimist, ehkki massiliselt erinevaid eesmärke silmas pidades.