Sisu
- Definitsioon
- Etüleendiamiintetraäädikhape ja potentsiomeetriline meetod
- Kompleksomeetriline tiitrimine
- Burette'i lahendus
Teadlased tuginevad keemiliste reaktsioonidega lahuses sisalduva aine koguse otsesele tiitrimisele. Õige toimimise korral saab see protsess keemiliste koguste väga täpselt kujutada spetsiaalsete hapete ja laboriklaaside abil. Tiitrimise nõuetekohaseks toimimiseks peab viimane kompleks moodustuma piisavalt kiiresti, et teadlased saaksid seda analüüsida.
Definitsioon
Otsene tiitrimine on viis aine sisalduse kvantitatiivseks määramiseks. Teadlased võivad reagendist teada olla, kuid ei tea reagendi kogust. Otsene tiitrimine põhineb mõnikord näitajatel, mis reageerivad analüüsitavale materjalile, mida nimetatakse analüüdiks. Teinekord põhinevad meetodid lisatud metalliioonide kasutamisel, mis on konkreetset tüüpi metalli üksikud aatomid või molekulid.
Etüleendiamiintetraäädikhape ja potentsiomeetriline meetod
Tehnikud saavad tiitrida metüleenindikaatoritega etüleendiamiintetraäädikhappe abil. See meetod ei tööta kõigis olukordades, kuna reaktsioon on mõnikord nii aeglane, et tiitrimine muutub ebareaalseks. Kasutatud metalliioonidel peab olema väiksem stabiilsus kui analüütil. Teine otsese tiitrimise meetod on potentsiomeetriline meetod, mida kasutatakse lõpp-punkti tuvastamiseks metalliioonidega, millel on konkreetsed saadaolevad elektroodid. Lõpp-punkt on punkt, kus tiitrimisprotsess lõpeb.
Kompleksomeetriline tiitrimine
Kompleksomeetriliseks tiitrimiseks kasutavad teadlased metallide identifitseerimiseks aminopolükarboksüülhappeid. Moodustuvad värvilised kompleksid ja teadlased kasutavad sellest moodustunud kogutud andmeid analüüdi koguse määramiseks. Kompleksomeetrilise tiitrimise otsene meetod hõlmab metalli-soolalahuse kasutamist, mis on tiitritud kompleksi moodustava ühendi lahusega. Komplekssed ühendilahused sisaldavad aatomeid või ühendeid, mis moodustavad komplekse teiste aatomite või ühenditega. Teadlased leiavad samaväärsuspunkti lisatud indikaatorist. Ekvivalentsuspunkt on siis, kui lisatud tiitrija on stöhhiomeetriliselt võrdne analüüsitava ainega. Stöhhiomeetria hõlmab keemiliste reaktsioonide tasakaalustamist.
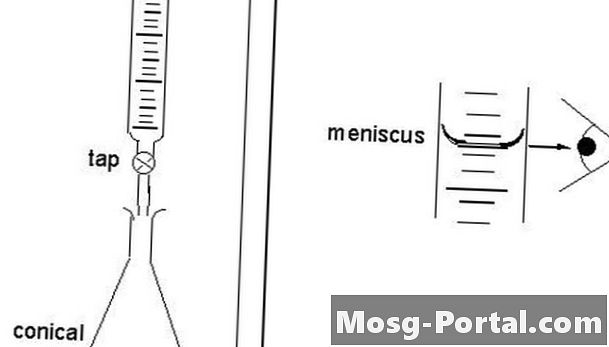
Burette'i lahendus
Otsest tiitrimist nimetatakse „otseseks”, kuna teadlane läheneb näitajale otse. Tiitrant siseneb lahusesse büretist pärit tilkade kaudu, nii et viimane tilk ei ületaks lõpp-punkti. Otsese tiitrimisega töötlevad teadlased lahuses sisalduvat lahustuvat ainet, mis asub tiitriks nimetatud anumas. Standarditud lahust nimetatakse tiitrijaks. Lõpp-punkt määratakse instrumendi abil või visuaalselt indikaatori abil. Teadlased lisavad tiitri õigesse büreeti, vertikaalsesse ja silindrilisse klaasnõusse, millel on täppiskraan, mis eraldab väikestes kogustes vedelikku kindla koguse korral. Teadlased täidavad büretti mahuga 30–100 protsenti.