Sisu
Keemilises reaktsioonis muundatakse lähteained, mida nimetatakse reagentideks, produktideks. Kui kõik keemilised reaktsioonid nõuavad algset energia sisendit, mida nimetatakse aktiveerimisenergiaks, siis mõnede reaktsioonide tagajärjel eraldub energia netokeskkonda ja teistes energia neeldumine ümbrusest. Viimast olukorda nimetatakse endergonic reaktsiooniks.
Reaktsioonienergia
Keemikud määratlevad oma reaktsioonianuma kui "süsteemi" ja kõike muud universumis kui "ümbrust". Seetõttu, kui endergonic reaktsioon neelab ümbritsevast energiat, siseneb see energia süsteemi. Vastupidine tüüp on eksergooniline reaktsioon, mille käigus energia vabaneb ümbritsevasse keskkonda.
Mis tahes reaktsiooni esimene osa nõuab alati energiat, olenemata reaktsiooni tüübist. Ehkki puidu põletamine annab soojust ja kui see algab, toimub see spontaanselt, peate protsessi alustama energia lisamisega. Leek, mille lisate puidu põletamiseks, annab aktiveerimisenergia.
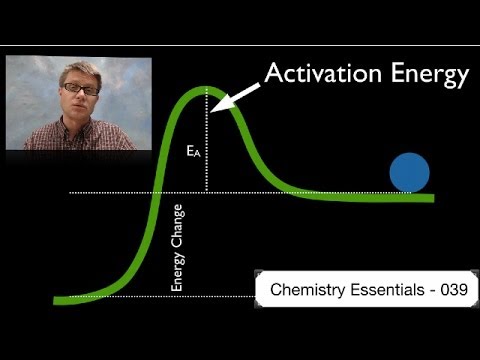
Aktiveerimise energia
Reaktandi küljest keemilise võrrandi produkti poolele jõudmiseks peate aktiveerimise energiabarjääri ületama. Igal üksikul reaktsioonil on iseloomulik barjääri suurus. Barjääri kõrgusel pole midagi pistmist sellega, kas reaktsioon on endergooniline või eksergooniline; näiteks võib eksergoonilisel reaktsioonil olla väga kõrge aktiveerimise energiabarjäär või vastupidi.
Mõned reaktsioonid toimuvad mitme sammuna, kusjuures igal etapil on oma aktiveerimise energiabarjäär, millest üle saada.
Näited
Sünteetilised reaktsioonid kipuvad olema endergonic ja reaktsioonid, mis molekulid lagundada kipuvad olema exergonic. Näiteks aminohapete liitumisprotsess valgu saamiseks ja glükoosi moodustumine süsinikdioksiidist fotosünteesi ajal on mõlemad endergoonsed reaktsioonid. See on mõistlik, kuna suuremate struktuuride ehitamise protsessid vajavad tõenäoliselt energiat. Pöördreaktsioon - näiteks glükoosi rakuhingamine süsinikdioksiidiks ja veeks - on eksergooniline protsess.
Katalüsaatorid
Katalüsaatorid võivad vähendada reaktsiooni aktiveerimise energiabarjääri. Nad stabiliseerivad vaheühendi, mis eksisteerib reagendi ja produkti molekulide vahel, muutes muundamise lihtsamaks. Põhimõtteliselt annab katalüsaator reagentidele madalama energiaga "tunneli" läbimiseks, mis hõlbustab aktiveerimise energiabarjääri jõudmist toote poolele. Katalüsaatoreid on palju, kuid tuntuimad neist on ensüümid, bioloogilise maailma katalüsaatorid.
Reaktsiooni spontaansus
Sõltumata aktiveerimise energiabarjäärist, toimuvad spontaanselt ainult eksergoonilised reaktsioonid, kuna need eraldavad energiat. Kuid me peame ikkagi lihaseid üles ehitama ja oma keha parandama, mis on mõlemad endergoonilised protsessid. Endergoonilist protsessi saame juhtida, ühendades selle eksergoonilise protsessiga, mis annab piisavalt energiat, et reageerida reagentide ja toodete energia erinevusele.