Sisu
Kui ioonne ühend lahustub, eraldub see selle koostisosadeks ioonideks. Kõik need ioonid ümbritsevad lahusti molekule, seda protsessi nimetatakse solvatsiooniks. Järelikult lisab ioonne ühend lahusesse rohkem osakesi kui molekulaarne ühend, mis sel viisil ei haju. Osmolaarsus on osmootse rõhu määramiseks kasulik.
Molaarsus vs osmolaarsus
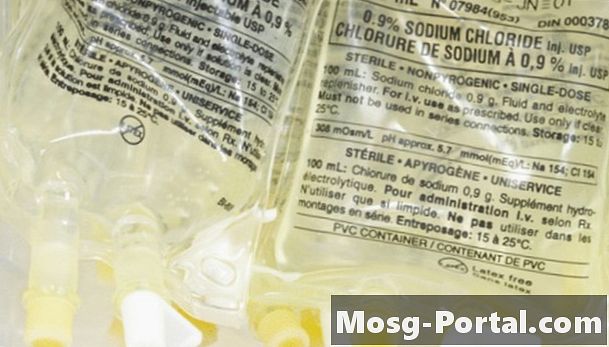
Keemikud kirjeldavad kontsentratsiooni tavaliselt molaarsuse järgi, kus mool on 6,022 x 10 ^ 23 osakest, iooni või molekuli ja ühe molaarse lahuse lahuse ühe liitri kohta on üks mool lahustunud ainet. NaCl ühe molaari lahus sisaldaks ühte mooli NaCl valemiühikuid. Kuna NaCl dissotsieerub vees Na + ja Cl-ioonideks, sisaldab lahus tegelikult kahte mooli ioone: ühte mooli Na + ioone ja ühte mooli Cl-ioone. Selle mõõtmise eristamiseks molaarsusest nimetavad keemikud seda osmolaarsuseks; soola ühe molaarse lahuse ioonide kontsentratsioon on kaks osmolaarset.
Tegurid
Osmolaarsuse määramisel on kõige olulisem lahuse molaarsus - mida rohkem lahustatakse mooli, seda rohkem ioone osmolaarselt on. Teine oluline tegur on aga ioonide arv, millesse ühend dissotsieerub. NaCl dissotsieerub kaheks iooniks, kaltsiumkloriid (CaCl2) aga dissotsieerub kolmeks: üheks kaltsiumiiooniks ja kaheks kloriidiooniks. Järelikult, kui kõik muu on võrdne, on kaltsiumkloriidi lahusel suurem osmolaarsus kui naatriumkloriidi lahusel.
Kõrvalekalle ideaalsusest
Kolmas ja viimane osmolaarsust mõjutav tegur on kõrvalekalle ideaalsusest. Teoreetiliselt peaksid kõik ioonühendid täielikult dissotsieeruma. Tegelikkuses jääb väike osa ühendist siiski eraldamata. Enamik naatriumkloriidi jaguneb vees naatriumi- ja kloriidioonideks, kuid väike osa jääb NaCl-na seonduma. Lahustumata ühendi kogus suureneb, kui ühendi kontsentratsioon suureneb, nii et see tegur võib kõrgematel kontsentratsioonidel muutuda olulisemaks probleemiks. Lahustunud aine madala kontsentratsiooni korral on kõrvalekalle ideaalsusest ebaoluline.
Tähtsus
Osmolaarsus on oluline, kuna see määrab osmootse rõhu. Kui lahus eraldatakse teisest erineva kontsentratsiooniga lahusest poolläbilaskva membraani abil ja kui poolläbilaskev membraan laseb veemolekulidel, kuid mitte ioonidel seda läbi viia, hajub vesi membraani läbi kontsentratsiooni suurenemise suunas. Seda protsessi nimetatakse osmoosiks. Teie keha rakumembraanid toimivad poolläbilaskvate membraanidena, kuna vesi võib neid ületada, ioonid aga mitte. Sellepärast kasutavad arstid IV infusiooniks soolalahust, mitte puhast vett; kui nad kasutaksid puhast vett, väheneks teie vere osmolaarsus, põhjustades sellistes rakkudes nagu punased verelibled vett ja lõhkemist.